ここ
ポイント
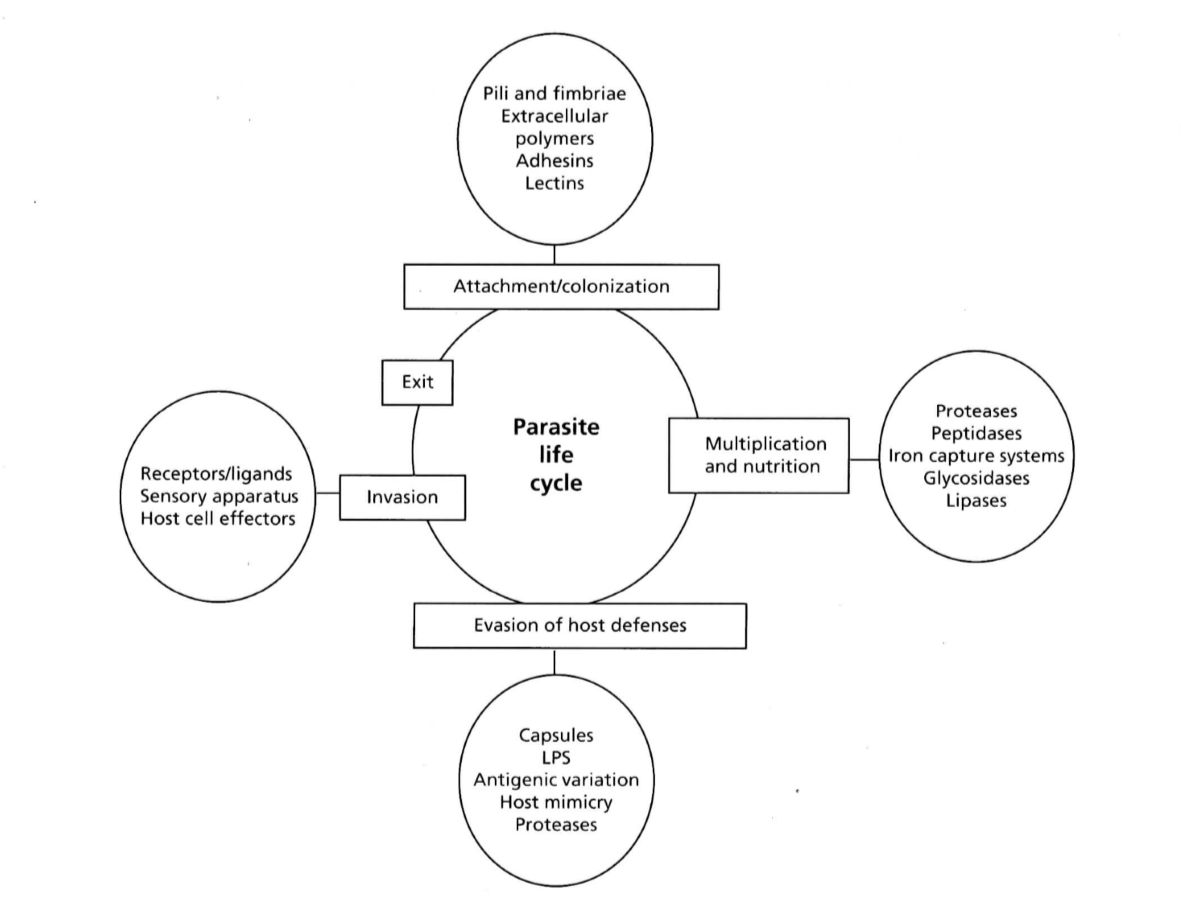
ある生物が他の生物に寄生するサイクルが上図です。歯周病菌が生体の防御力をどのように回避して、毒性を発揮するかについて書かれています。
| Clinical Periodontology and Implant Dentistry 第6版第10章“Periodontal infection(歯周感染症)”のPeriodontal bacterial and virulence(歯周細菌と毒性)(210~212)の訳を掲載します。 |
微生物の毒性
微生物病原体の毒性は、一般に、実験的に調べられた病原性の程度または病気を引き起こす微生物の能力として定義されます。
それは非常に複雑なパラメーターの組み合わせで、生物の相対的な感染力と生成される疾患の重症度の両方に依存します。
しかし、すべての場合において、感染性と疾患の重症度のこれら2つのパラメーターは、宿主生物の性質と状態、またはその宿主におけるコロニー形成の場所に大きく影響されます。
したがって、宿主の通常の防御バリアの裂け目、 たとえば、外傷、免疫抑制/機能不全または他の生物との共感染は、特定の生物の毒性を劇的に増加させる可能性があります。
そこで、微生物の病原性の説明は、根本的には、定着した宿主の相対的な感受性の理解に依拠するわけです。
The virulence of a microbial pathogen is generally defined as the degree of pathogenicity or ability of the organism to cause disease as measured by an experimental procedure. It represents a combination of highly complex parameters and depends upon both the relative infectivity of the organism and the severity of the disease produced. However,in all cases, these two parameters of infectivity and disease severity are profoundly influenced by the nature and status of the host organism or the site of colonization in that host.Thus,a breach in the normal defensive barriers of the host through, for example, trauma, immunosuppression/dysfunction or co-infection by another organism,can dramatically increase the virulence of a given organism. Hence, any description of microbial virulence is fundamentally reliant on an understanding of the relative susceptibility of the colonized host.
病原体のライフサイクル
ある生物が他の生物に寄生するライフサイクルの必要な段階と伝播が上図に示されています。
主な段階は次のとおりです。最初のコロニー形成と定着;増殖と栄養摂取;宿主防御の回避;(場合によっては)侵入;そして最後に、新しい宿主に伝播するための退出。
これらの各プロセスを促進するには、特定の遺伝子産物(推定病原因子)が必要であり、これらの産物は、ライフサイクルの各要素を満たすために使用される特定の戦略に応じて、生物によって異なります。
上図に示すライフサイクルの各ステップに関連する遺伝子産物または形質は、複数の生物から引き出された例を表します。
病気は、影響を受けやすい宿主を前提にして、これらの病原体のライフサイクル段階における宿主の応答が好ましくない結果をもたらすこととして定義できます。
The requisite stages in the life cycle and spread of one organism which parasitizes another are presented in Fig・10-14. The key steps are : initial colonization and attachment ; multiplication and nutrition;evasion of the host defenses;(in some cases)invasion;and,lastly,exit in order to disseminate to a new host. Specific gene products(presumptive virulence factors)are required to facilitate each of these processes, and these products will vary from organism to organism dependent upon the particular strategy employed to satisfy each element of the life cycle. The gene products or traits associated with each step in the life cycle presented in Fig.10-14 represent examples drawn from multiple organisms.Disease can be defined as the unfavorable outcome in the host from the application of these life cycle stages of the pathogen in a susceptible host background.
病原性決定因子
病原体の病原性決定因子は、罹患した宿主生物内での定着、成長、および生存を促進し、新しい宿主に広がる遺伝子産物として簡単に定義することができます。
いくつかの重要な歯周微生物、P.gingivaris、A.actinomycetemcomitans、T.forsythia、およびT.denticolaの毒性特性の例が研究されています。
ほとんどの場合、これらの決定要因をこれらの生物の毒性の重要な決定要因であると考える根拠は、豊富なin vitro調査および/または目的の遺伝子の同質遺伝子変異体を使用する動物モデルに由来します。
これらの特性の詳細疾患の病因に関連する微生物は、この主題に関する最近のレビューで見つけることができます(Hajishengallis2009; HendersoneEal。 2010; Sharma2010; Dashperetal・2011; Bostanci&Belibasakis 2012)。
しかし、これらの生物のいくつかの新たな主要特性は、歯周組織の宿主防御から逃れるために細菌がとっているようにみえる戦略に関係しています。
The virulence determinants of a pathogen can simply be defined as those gene products which facilitate colonization, growth, and survival within the diseased host organism and spread to a new host. Examples of the virulence properties of some key periodontal organisms,P.gingivaris, A.actinomycetemcomitans, T.forsythia,and T.denticola, are given inTablel0-3. In most cases, the rationale for considering these determinants to be important determinants of the virulence of these organisms is derived from a wealth of in vitro investigations and/or animal models employing isogenic mutants of the gene of interest. Further details of the properties of these organisms in relation to the pathogenesis of disease can be found in recent reviews on this subject(Hajishengallis2009;HendersoneEal. 2010;Sharma2010;Dashperetal・2011;Bostanci& Belibasakis 2012). However, an emerging key property of several of these organisms concerns the strategies they appear to employ in order to evade the host defenses operative in the periodontium.
微生物の戦略
それぞれの宿主の生来の防御システムと共進化した微生物が、防御的な宿主の障壁を克服するだけでなく、これらのシステムを操作して独自の利点を得るための戦略を開発していることがますます明らかになってきています。
この現象の1つの例は、A.actinomycetemcomitansやP.gingivalisなどのグラム陰性菌とグラム陽性菌の両方の細胞表面タンパク質が、宿主細胞によるサイトカイン発現のパターンに影響を与える能力です。
「細菌モジュリン」という用語は、真核細胞の挙動を調節する能力があるため、これらの細菌サイトカイン誘導分子を説明するためにHenderson、Poole、およびWilsonによって導入されました(Hendersonetali1996)。
最近では、P.gingivalisによる宿主応答の洗練された操作が、この細菌のリポ多糖(LPS)の脂質A部分のさまざまな分子種の生物学的特性の結果として説明されています(Darveauetal. 2004)。
これらのリピドA種は、Toll-like受容体シグナル伝達を介して宿主応答の作用物質として作用することができ、したがって腸内生物のヘキサアシル化リピドA種と同様の生物学的特性を持っています。
逆に、P.gingivalisによって生成された他のリピドA部分は、このシグナル伝達経路の拮抗物質として作用し、炎症誘発性リピドA形態の活性をブロックすることができます。
これは、異なるリピドA成分の比率を変更することにより、P.gingivalisが、たとえば防御的対策としての炎症反応の調節を低下するために、自然反応を操作できる可能性があることを示唆しています。
It is becoming increasingly evident that microbial organisms, having co-evolved with the innate defense systems of their respective hosts, have developed strategies not only to overcome protective host barriers but also to manipulate these systems to their own advantage. One example of this phenomenon is the ability of cell surface proteins of both Gram-negative and Gram-positive bacteria, including A.actinomycetemcomitans and P.gingivalis,to influence the pattern of cytokine expression by host cells. The term “bacterial modulins” was introduced by Henderson,Poole,and Wilson to describe these bacterial cytokine inducing molecules because of their ability to modulate eukaryotic cell behavior(Hendersonetali1996). More recently,a sophisticated manipulation of the host response by P.gingivalis has been described as a consequence of the biologic properties of different molecular species of the lipid A portion of the lipopolysaccharide(LPS)of this bacterium(Darveauetal・ 2004).Some of these lipid A species are able to act as agonists of the host response through Toll-like receptor signaling, and thus have similar biologic properties to the hexa-acylated lipid A species of enteric organisms. Conversely, other lipid A moieties produced by P.gingivalis act as antagonists of this signaling Pathway and are able to block the activity of the pro-inflammatory lipid A forms. This has led to the suggestion that by altering the proportions of the different lipid A components, P.gingivalis may be able to manipulate the innate response in order ,for example, to down regulate the inflammatory response as a defensive measure.
歯周細菌の免疫防御回避策
より特徴付けられた歯周細菌の一部が実践する追加の回避策は、他の宿主の細胞,主に上皮細胞に侵入することを含む、免疫特権サイトへのアクセスを得るためのいわゆる「ステルス技術」の構成要素です(Lamont&Jenkinson1998 Fives Taylor et al.1999; Meyer et al・1999)。
生体内でのこのプロセスの検証は、口から直接採取した頬側上皮細胞内の蛍光標識を使用したこれらおよび他の種の検出から明らかになりました(Rudneyetal. 2005)。
P.gingivalisの場合、この生物はヒト歯肉由来の上皮細胞に急速に侵入し、核周囲に局在して多数蓄積し、持続することが示されています(Lamont&Jenkinson2000)。
この位置付けは、上皮細胞の原形質膜を移動させることができるRgpAの精製された調製物で観察された局在に似ています(Scragg et al. 2002)。
正確なメカニズムはまだ調査中ですが、主要な線毛であるFimA、およびジンジパインプロテイナーゼは、細菌細胞の付着および内部移行に必要です。
A.actinomycetemcomitansの場合、メカニズムの正確な詳細は不明ですが、唾液に由来する可溶性CD14によって侵入プロセスが増強される可能性があることを示唆しています(Takayama et al.2003)。
An additional evasive measure practiced by some of the better characterized periodontal bacteria,a component of the so-called, “stealth technology”, involves entry into other host cells, primarily epithelial cells, to gain access to an immune-privileged site(Lamont&Jenkinson1998 Fives Taylor et al.1999;Meyer et al・1999). Verification of this process in vivo is now emerging from the detection of these and other species using fluorescent labeling within buccal epithelial cells taken/directly from the mouth(Fig・10-15)(Rudneyetal・2005). In the case of P.gingivalis,the organism has been shown to rapidly invade epithelial cells derived from the human gingiva and accumulate and persist in high numbers with a perinuclear localization(Lamont&Jenkinson 2000). This positioning is similar to the localization observed for purified preparations of RgpA, which is able to translocate the plasma membrane of epithelial cells(Scragg et al.2002). While the precise mechanism is still under investigation, FimA, a major fimbriae, and the gingipain proteinases are required for the attachment and internalization of the bacterial cells.In the case of A.actinomycetemcomitans, While the precise details of the mechanism are unknown, there is a suggestion that the invasion process may be augmented by solubleCD14 derived from saliva(Takayama et al.2003).
歯周病に関与するいくつかの主要な生物の毒性特性が抗炎症性または破壊的表現型に向けられている可能性があるという認識は、疾患プロセスの病因の新たな認識につながり、これはこの章の最後のセクションに示されています。
The recognition that the virulence properties of some of the key organisms involved in periodontal disease may be more directed towards an anti-inflammatory or subversive phenotype is leading to a new appreciation of the etiopathogenesis of the disease process and this is presented in the final section of this chapter.
| 歯周病の新常識 小西昭彦 阿部出版 |
歯科治療の新常識 小西昭彦 阿部出版 |